"2º AN0" 4º BIMESTRE-2024: Eletroquímica e Equilíbrio Químico
Eletroquímica
É o estudo das reações químicas que produzem corrente elétrica ou são produzidas pela corrente elétrica.
Pilha de Daniel: é uma aplicação de eletroquímica, que procuraremos entender através do esquema abaixo, como uma reação química que produz corrente elétrica:

O esquema acima tem que ser visto em duas partes a inicial à esquerda da seta e a final à direita da seta:
No início temos:
_ dois recipientes conectados por uma ponte salina, que permite a passagem de íons entre as duas soluções;
_ a solução do 1º recipiente é constituida de sulfato de cobre dissolvido em água (CuSO4 + H2O-->Cu2+(aq) + SO42-(aq)), enquanto no 2º recipiente é constituida de sulfato de zinco dissolvido em água (ZnSO4 + H2O--> Zn2+(aq) + SO42-(aq));
_ no 1º recipiente temos o eletrodo constituido de átomos de cobre (Cu) enquanto no 2º temos o eletrodo constituido de átomos de zinco (Zn), os dois sendo ligados através de um fio metálico, que é um bom condutor de corrente elétrica;
Ocorrência da eletroquímica:
_ O eletrodo de zinco apresenta um potencial de redução (E0) igual à -0,76 V, que é menor que o potencial de redução (Eo) do eletrodo de cobre +0,34 V, sendo assim o zinco sofrerá oxidação (perda de elétrons) e será chamado de ânodo "polo negativo" enquanto o cobre sofrerá redução (ganho de elétros) e será chamado de cátodo "polo positivo", com isso é possível a compreensão do sentido da corrente elétrica (fluxo de elétrons) do eletrodo de zinco para o eletrodo de cobre, o que faz a lâmpada acender;
_ Com a oxidação do zinco o átomo se transforma em íon Zn2+, este por sua vez se dissolve na solução fazendo com que a massa do eletrodo diminua (veja eletrodo da parte final) , mas em contra partida aumenta a concentração da solução de ZnSO4 "Zn2+ excede";
_ Com a redução do íon de cobre, que antes estava na solução e ao se transformar em átomo acaba promovendo a diminuição da concentração da solução simultaneamente aumenta a massa do eletrodo (veja eletrodo da parte final), "SO42- na solução excede";
- Considerando que íon de zinco excede no 2º recipiente e que íon de sulfato excede no 1º recipiente ocorre uma movimentação (troca) de íons pela ponte salina.
Características gerais de uma pilha:
_ ddp (diferença de potencial) ou fem (força eletromotriz) em condições padrão (soluções 1mol/L e a 25ºC) é a diferença entre o Eo do oxidante (cátodo) e o Eº do redutor (ânodo).
_ a pilha acima pode ser assim representada Znº|Zn2+ || Cu2+|Cuº sendo padrão o 1º elemento ser o que sofre oxidação e o 2º o que sofre redução;
_ espontaneidade das reações de oxi-redução é quando o cálculo da ddp ou fem tiver resultado positivo.
_ Corrosão: é a destruição ou deterioração de um material devido à reação química ou eletroquímica com seu meio, processo no qual um metal retorna ao seu estado original.
Atividades:
1) As pilhas são largamente utilizadas no mundo moderno, e o esquema abaixo mostra uma pilha montada a partir de placas de níquel e zinco. Com base na informação e em seus conhecimentos sobre eletroquímica, pode-se afirmar que:
Dados:
Zn 2+ (aq) + 2 e – --> Zn (s) E0 = – 0,76 V.
Ni 2+ (aq) + 2 e – --> Ni (s) E0 = – 0,25 V.
a) A concentração dos íons Ni 2+ na solução de NiSO4 aumenta.
b) A concentração de íons nas soluções não afeta o funcionamento da pilha.
c) A ponte salina evita a migração de íons do ânodo para o cátodo.
d) A placa de zinco diminui de massa.
e) O potencial de oxidação do níquel é maior que o do zinco.
f) O ddp da pilha é igual a + 0,51V
g) O Ânodo é o eletrodo de Níquel
h) O eletrodo de Zn sofre Redução
Corrosão:
_ dois elementos com potenciais de redução diferentes que estão em contato promovem a reação de oxirredução;
_ a umidade e o oxigênio são fundamentais para a ocorrência dessa reação;
_ a presença de substâncias ácidas e/ou ambientes salinos aceleram essa reação;

Acima notamos a reação de oxidação por parte do ferro e a redução por parte do oxigênio atmosférico, acarretando na corrosão do material de ferro e formação da ferrugem "Fe(OH)2".
Processos de Proteção à corrosão:
Proteção anódica: é o meio pelo qual procura-se evitar o contato do material a ser corroído com o oxigênio através do uso de substâncias como zarcão e tintas.
Proteção catódica: é o meio pelo qual não se evita o contato com o oxigênio, porém este contato ocorre com um metal "metal de sacrifício" que protege o metal interno que apresenta um potencial de redução maior:

Acima notamos que o ferro (Eº = - 0,44 V) em relação ao zinco (Eº = - 0,76 V) é menos reativo, pois apresenta maior potencial de redução e neste caso sendo preservado e a corrosão será sofrida pelo zinco que neste caso será o "metal de sacrifício". Este processo citado acima envolvendo estes metais é chamado de Galvanização.
Atividades:
2) O alumínio sofre corrosão em contato com o ferro. Para efetuar uma proteção catódica, qual dos metais a seguir é o mais indicado? E qual é a equação química correspondente?
Dados:
Al3+(aq) + 3 e- → Al(s) E0 = -1,67 V
Zn2+(aq) + 2 e- → Zn(s) E0 = - 0,76 V
Cu2+(aq) + 2 e- → Cu(s) E0 = +0,34 V
Mg2+(aq) + 2 e- → Mg(s) E0 = - 2,38 V
Ni2+(aq) + 2e- → Ni(s) E0 = -0,25 V
a) Alumínio. Equação: Fe + Al3+→ Fe3+ + Al
b) Zinco. Equação: 3 Zn + 2 Al3+→ 3 Zn2+ + 2 Al
c) Cobre. Equação:3 Cu + 2 Al3+→ 3 Cu2+ + 2 Al
d) Magnésio. Equação:3 Mg + 2 Al3+→ 3 Mg2+ + 2 Al
e) Níquel. Equação: 3 Ni + 2 Al3+→ 3 Ni2+ + 2 Al
Eletrólise: é a reação de oxi-redução provocada forçadamente pela corrente elétrica, dividida em ígnea e aquosa:
Eletrólise ígnea: ocorre com composto iônico fundido, que nessa condição os íons ficam livres para se movimentarem:

_ os elétrons chegam no Cátodo (-) e promovem a redução do cátion, que se torna átomo Na;
_ o ânion se direciona para o Ânodo (+) e sofre oxidação se transformando em átomo Cl;
_ as ações acima são representadas e se resumem na equação:

Eletrólise aquosa: ocorre com composto em solução aquosa, que nessa condição os íons ficam livres para se movimentarem, porém a diferença é que há concorrência entre os ânions e cátions para haver redução e oxidação, que será definido mediante a caracteristicas citadas abaixo:


Observando o sistema acima e a equação global nota-se que:
_o cátion H+ ganha do Na+, ou seja, quando o cátion do sal for da família IA, IIA ou IIIA, quem vai sofrer redução vai ser o Hidrônio (H+);
_enquanto que o ânion Cl- sofrera oxidaçao em relaçao ao OH-.pois ele não esta acompanhado de oxigenio e nem fluor; quando assim, quem sofrera oxidaçao será a hidroxila (OH-).
Atividades:
3) Assinale a alternativa correta sobre a eletrólise:
a) A reação que ocorre no cátodo é de oxidação.
b) A reação que ocorre no ânodo é de redução.
c) O cátodo fornece elétrons dos cátions do eletrólito e tem sinal positivo.
d) O ânodo recebe elétrons dos ânions do eletrólito e tem sinal positivo.
e) Na eletrólise, a energia química é transformada em energia elétrica.
4) A eletrólise ígnea do brometo de magnésio é representada pela equação química a seguir:
MgBr2(l) → Mg(s) + Br2(g)
Pode-se afirmar que, durante essa eletrólise:
a) há liberação de energia elétrica.
b) os íons Mg2+ oxidam-se.
c) os íons Mg2+ reduzem-se.
d) o eletrodo em que é formado magnésio metálico é o ânodo.
5) Na eletrólise de uma solução aquosa de NaCl, a solução:
a) torna-se ácida em virtude da formação de HCl.
b) torna-se básica em virtude da formação de NaOH.
c) permanece neutra em virtude da formação de H2 e Cl2.
d) permanece neutra em virtude da formação de H2 e O2.
e) permanece neutra em virtude da formação de O2 e Cl2.
Equilíbrio Químico
Reação Química Reversível: é a reação na qual temos a formação de produtos por parte de reagentes e estes sendo formados por parte dos produtos, à medida que estes passam a ser formados. Sendo característico a presença de uma dupla seta, com mesma direção e sentidos opostos; no sentido para a direita, formando produtos, temos a reação direta, e a seta no sentido para a esquerda, formando reagentes, temos a reação inversa:

Estado de Equilíbrio Químico: é o estado no qual as velocidades das reações direta e inversa, de uma reação química reversível, se igualam, e as massas das substâncias da reação permanecem constantes, numa dada temperatura e sem que haja trocas do sistema com o ambiente. Sendo este equilíbrio caracterizado como dinâmico, ou seja, ao atingí-lo a reação não para de acontecer, pelo contrário, se 100 moléculas de reagentes se transformam em produtos estes simultaneamente estarão se transformando e repondo as 100 moléculas de reagentes, assim o valor total não se altera. Esses dizeres podem ser representados por dois gráficos:
.png)
.png)
Obs: o 2º gráfico concentração X tempo acima demonstra uma reação no qual os reagentes apresentam um valor maior de massa do que o produto, nessa reação, a partir do equilíbrio químico, mas pode haver reação química na qual a massa dos produtos após o equilíbrio químico seja igual ou maior do que a massa dos reagentes:


A pro
Atividade:
1) (UFRS-adaptada) Uma reação química atinge o equilíbrio químico quando:
a) a reação química é irreversível.
b) as velocidades das reações direta e inversa são iguais.
c) os reagentes são totalmente consumidos.
d) os reagentes e produtos tem que apresentar a mesma quantidade.
e) antes de começar a reação química.
Equilíbrio químico homogêneo: as substâncias reagentes e produtos encontram-se numa mesma fase "todos em mesmo estado físico, principalmente gasosos ou aquosos e liquidos, por exemplo".
Equilíbrio químico heterogêneo: as substâncias reagentes e produtos encontram-se em fases diferentes "estados físicos diferentes, por exemplo".
Atividade:
2) Classifique os seguintes equilíbrios em homogêneos ou heterogêneos:
a) 2 NO(g) + O2(g) ↔ 2 NO2(g)
b) PCℓ5(g) ↔ PCℓ3(g) + Cℓ2(g)
c) 4 HCℓ(g) + O2(g) ↔ 2 H2O(l) + 2Cℓ2(g)
d) C(s) + H2O(g) ↔ CO(g) + H2(g)
e) Mg(s) + 2H+(aq)↔ Mg2+(aq) + H2(g)
Constantes de equilíbrio (K)
É a relação entre os produtos e os reagentes, sendo usadas para fins de cálculo apenas as substâncias gasosas ou em solução aquosa:


_quando o seu valor é pequeno, indica que a quantidade de reagentes é maior do que a de produtos, com isso concluimos que as condições favorecem o equilíbrio no sentido da formação de reagentes, ou seja, para o sentido da reação inversa;
_quando o seu valor é grande, indica que a quantidade de reagentes é menor do que a de produtos, com isso concluimos que as condições favorecem o equilíbrio no sentido da formação de produtos, ou seja, para o sentido da reação direta;
_as constantes de equilíbrio determinadas com base nas concentrações, em mol/L, a uma dada temperatura são representadas por Kc;
_as constantes de equilíbrio determinadas com base nas pressões parciais, referente apenas nas substâncias gasosas, a uma dada temperatura são representadas por Kp;
A relação existente entre Kc e Kp é dada por: Kp = Kc . (R . T)∆n
Atividade:
3) (UEMA) Na reação:
aA + bB ↔ c C + d D,
após atingir o equilíbrio químico, podemos concluir a constante de equilíbrio:
Kc = [C]c. [D]d
[A]a. [B]b
a respeito da qual é correto afirmar que:
a) quanto maior for o valor de Kc, menor será o rendimento da reação direta.
b) Kc independe da temperatura.
c) se as taxas de desenvolvimento das reações direta e inversa forem iguais, então Kc = 0.
d) Kc depende das concentrações em quantidade de matéria iniciais dos reagentes.
e) quanto maior for o valor de Kc, maior será a concentração dos produtos.
Fatores que pertubam o equilíbrio químico: o equilíbrio químico de uma reação pode ser perturbado causando um desequilíbrio, porém, a reação química promove ações para minimizar essa peturbação, alcançando um novo equilíbrio com novas concentrações, o que chamamos de lei de Le Chatelier, o que detalharemos abaixo:
*A Concentração dos participantes do equilíbrio:
Reagentes Produtos
CH3COOH(L) + C2H5OH < -- > CH3COOC2H5(L) + H2O(L)
ADIÇÃO DE UM REAGENTE -- > A reação é forçada a produzir maiores
quantidades dos produtos (deslocamen-
to do equilíbrio para a direita).
A reação é forçada a produzir < -- ADIÇÃO DE UM PRODUTO
maiores quantidades de reagen-
tes(deslocamento do equiíbrio
para a esquerda).
CH3COOH(L) + C2H5OH < -- > CH3COOC2H5(L) + H2O(L)
RETIRADA DE UM REAGENTE < -- A reação é forçada a produzir maiores
quantidades dos próprios reagentes
(deslocamento do equilíbrio para à
esquerda).
A reação é forçada a produzir -- > RETIRADA DE UM PRODUTO
maiores quantidades dos próprios
produtos (deslocamento do equiíbrio
para à direita).
* A pressão total sobre o sistema: a pressão só influência no equilíbrio químico de uma reação com participante gasoso e que apresenta variação de volume (diferença do número de mols, quando a reação estiver balanceada) do lado de reagentes para com o lado de produtos:
N2O4(g) <--> 2 NO2(g)
1 mol 2 mols
1 volume 2 volumes
O aumento da pressão total desloca o equilíbrio no sentido de menor volume, pois a redução no volume minimiza o efeito da pressão aplicada.
A redução da pressão total desloca o equilíbrio no sentido de maior volume, pois o aumento de volume minimiza a redução da pressão.
* A temperatura:
N2(g) + 3 H2(g) < -- > 2 NH3(g) ∆H = - 109,5 Kj ( a reação direta é exotérmica)
O aumento da temperatura desloca o equilíbrio no sentido endotérmico, reação inversa, (de modo que a absorção de calor pela reação venha a minimizar a elevação da temperatura no sistema).
A diminuição da temperatura desloca o equilíbrio no sentido exotérmico, reação direta, (de modo que a liberação de calor pela reação venha a minimizar a diminuição da temperatura no sistema).
* O catalisador: diminui o tempo necessário para atingir o equilíbrio, mas não altera o próprio estado de equilíbrio, isto é, não altera o rendimento (as massas de reagentes e produtos) obtido no processo:
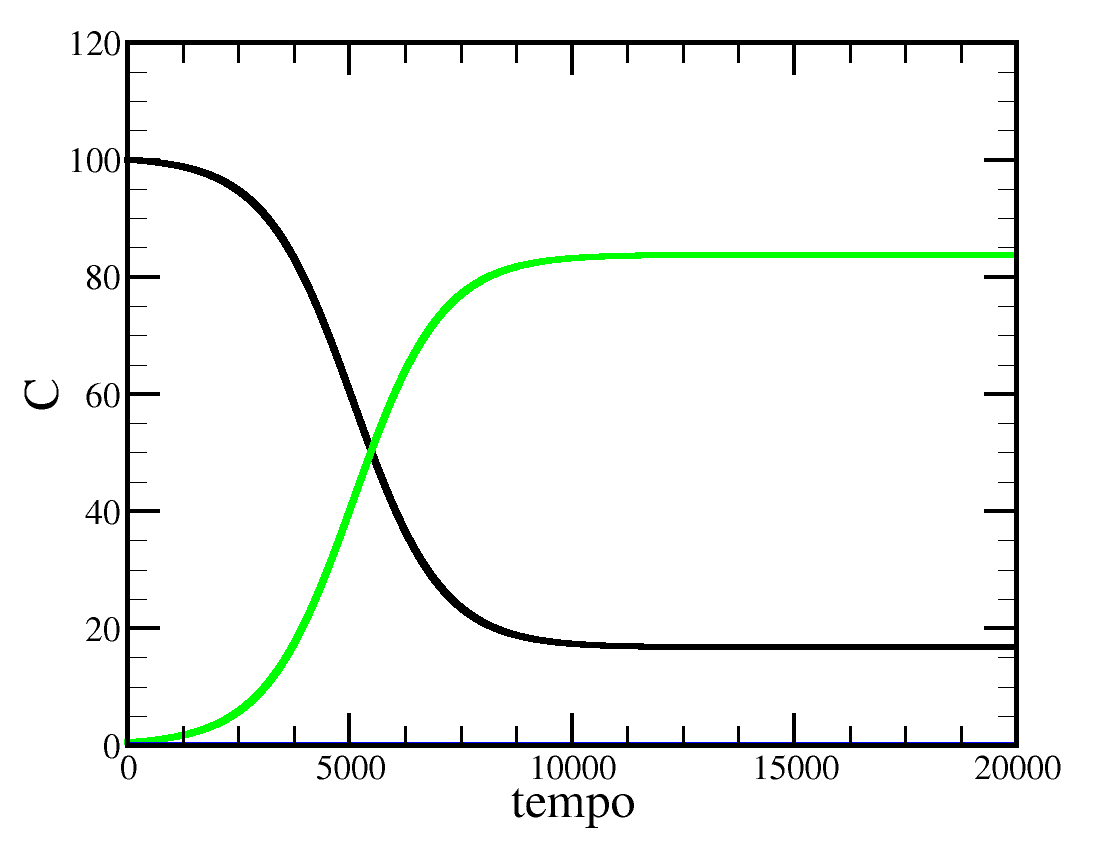
O gráfico acima representa uma reação em equilíbrio, a partir do tempo 10000, sem catalisador, com massa de produtos igual à 85 e de reagentes igual à 15. Se nesta mesma reação for adicionado um catalisador as massas de produtos e reagentes serão as mesmas, porém, o tempo para atingir o equilíbrio químico será menor do que 10000.
Atividade:
4) Considerando o equilíbrio
2 H2S(g) + 3 O2(g) ↔ 2 H2O(g) + 2 SO2(g) ∆H = -1036 kJ
e seguindo o Princípio de Le Chatelier, coloque a letra “E” nas alternativas em que o equilíbrio químico é deslocado para a esquerda e “D” quando ele é deslocado para a direita:
( ) diminui-se a temperatura do sistema.
( ) aumenta-se a pressão do sistema.
( ) adiciona-se dióxido de enxofre ao sistema.
( ) retira-se gás oxigênio do sistema.
( ) adiciona-se um gás inerte ao sistema, sem alterar o volume do sistema.
( ) Adicionar um catalisador no sistema.
"2º AN0" 4º BIMESTRE-2024: Eletroquímica e Equilíbrio Químico
Nenhum comentário encontrado.
