"2º ANO" 1º BIMESTRE-2025: Radioatividade, Teoria Cinética Molecular e Estudo dos Gases.
Radioatividade
Habilidades Cognitivas:
(EM13CNT311MG) Investigar e analisar comportamentos específicos dos diversos tipos de ondas, para avaliar suas diferentes aplicações tecnológicas (comunicação, saúde, música, entre outros), identificar e/ou avaliar os impactos individuais, coletivos e socioambientais de tais tecnologias, a fim de promover seu uso seguro e sustentável
Ondas eletromagnéticas
Ondas eletromagnéticas são aquelas que resultam da libertação das fontes de energia elétrica e magnética em conjunto. Elas são formadas pelo campo elétrico e o magnético, se propagando no vácuo à velocidade da luz, cerca de 300 000 km/s. Por esse motivo, recebe o nome de onda eletromagnética.
Radiações não ionizantes
A radiação não ionizante não tem energia suficiente para remover elétrons de um átomo por apresentar baixa frequência e baixa liberação de energia. Entretanto, conseguem mover os átomos ou fazê-los vibrar:
Luz visível;
Ondas de rádio;
Micro-ondas;
Ultravioleta;
Infravermelho.
Radiações ionizantes
A radiação ionizante tem a capacidade de produzir íons ao arrancar elétrons de um átomo. Por possuir maior energia, pode separar elétrons de outros átomos ou ionizá-los à medida que penetra a matéria:
alfa;
beta;
gama.
Equipamento de detecção das radiações:
.jpg)
Alfa: é uma radiação corpuscular (partícula) constituida de dois prótons + dois nêutrons; enfim alfa apresenta um número total de massa igual a 4 e número atômico igual a 2, onde a relação de carga positiva(prótons) e carga neutra (neutrôns) configura alfa como carga predominante positiva, assim será desviada por atração à placa negativa, porém com baixa intensidade de desvio por apresentar uma massa grande:

Beta: também se trata de uma radiação corpuscular, constituida por um elétron, porém este não pertence à eletrosfera, ele tem origem do núcleo com a quebra de um nêutron, que se transforma num próton e num neutrino, estes ficando retidos no núcleo, enquanto o elétron (Beta) é liberado para o meio externo; sendo assim Beta é atraida pela placa positiva e apresenta um desvio maior do que alfa por apresentar uma massa menor:

Gama: é uma onda eletromagnética, não possuindo carga e nem massa, ou seja, não é corpuscular,assim sendo não sofrerá desvio por não ser atraida nem pela placa positiva e nem pela placa negativa:

ATIVIDADES
1) Qual é a carga da radiação gama?
2) Qual o motivo da radiação alfa apresentar um desvio menos intenso na sua trajetória em relação à radiação beta?
3) Observe a equação nuclear abaixo:
94Pu242 --> 95Am242 + Z
Nessa equação, é correto afirmar que Z corresponde a qual radiação?
Decaimento
Uma vez que se tem conhecimento estrutural e comportamenal de alfa, beta e gama podemos compreender o que acontece com um elemento radioativo que venha a emitir essas radiações (decaimento):
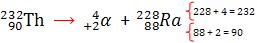
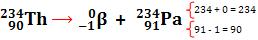
Obs: a emissão de gama não altera os números de massa e atômico, pois gama é uma onda eletromagnética isenta de massa.
ATIVIDADE
4) O elemento netúnio (93Np237), após a emissão de duas partículas alfa e três partículas beta, transforma-se num elemento químico com quais números de massa e atômico, respectivamente?
Poder de penetração das radiações:

Como visto acima, alfa apresenta um poder de penetração menor por apresentar uma massa relativamente grande em relação à gama (que não apresenta massa), e quanto maior a massa significa dificuldade de ultrapassar os espaços entre os átomos que constituem o material à sua frente.
Meia-vida ou período de semidesintegração (t1/2): se trata do período que o material radioativo gasta (emitindo radiação) para se reduzir à metade de sua composição, seja em massa, em número de átomos etc...

ATIVIDADE
5) O xenônio-133 é usado em pesquisas sobre os pulmões, e sua meia-vida ou período de semidesintegração é de cinco dias. Se uma amostra contiver 200 mg de xenônio-133, qual era a sua massa a 10 dias?
Fissão Nuclear: se baseia na fragmetação de um material radioativo colidido por um nêutron, transformando-se em elementos químicos menores, além da liberação de mais nêutrons, seguindo a lei de Lavoisier:

Observação: relação da massa envolvida no momento inicial e final da fissão acima: 1 + 235 = 139 + 94 + 3 x (1).
Fusão Nuclear: se baseia na formação ao menos de um elemento químico maior, a partir de dois menores, que se colidiram, seguindo a lei de Lavoisier:
Observação: a relação que se faz energéticamente entre fissão e fusão nuclear é que a fusão apresenta em média uma quantidade energética 200 vezes maior em proporção à fissão nuclear.
ATIVIDADE
6) A equação nuclear abaixo se refere:

a) decaimento b) fusão nuclear c) fissão nuclear d) combustão
Teoria Cinética Molecular
Habilidades Cognitivas:
(EM13CNT102XB) Realizar previsões, avaliar intervenções e/ ou construir protótipos de sistemas térmicos que visem à sustentabilidade, considerando sua composição e os efeitos das variáveis termodinâmicas sobre seu funcionamento, considerando também o uso de tecnologias digitais que auxiliem no cálculo de estimativas e no apoio à construção dos protótipos.
A teoria Cinética dos gases foi sintetizada com o intuito de explicar as propriedades e o comportamento interno dos gases. Compreender essa teoria é algo fundamental para o entendimento da pressão que os gases exercem em outros corpos e em várias outras aplicações. Os principais postulados dessa teoria Cinética dos gases, nos dizem que:
• Os gases são constituídos por um grande número de partículas que estão em movimento contínuo e aleatório, o que justifica a facilidade com que os gases escapam de recipientes.
• O volume da partícula quando gasosa é sempre desprezível.
• A pressão que um gás exerce é o resultado das colisões das partículas do gás com as paredes do recipiente que o contém. As partículas não perdem energia nas colisões (choques elásticos).
• A temperatura absoluta do gás é diretamente proporcional à energia cinética média de suas moléculas:
Ecinética média = K . T
• Não existem forças de atração ou repulsão entre as partículas de um gás ideal. As forças intermoleculares são desprezíveis. O comportamento de um gás real se aproxima ao de um gás ideal quando a pressão diminui e a temperatura aumenta. Quanto mais fracas são as forças intermoleculares do gás real , mais o gás se aproxima do comportamento de um gás ideal.
ATIVIDADES
7) Qual das figuras a seguir não apresenta uma característica dos gases em consonância com a teoria cinética molecular dos gases?

8) (UFPE) - Uma lata de “spray“ qualquer foi utilizada até não mais liberar seu conteúdo. Neste momento, podemos dizer que são corretas as alternativas de acordo com a teoria cinética dos gases:
a) A pressão de gases no interior da lata é zero.
b) A pressão de gases no interior é igual à pressão atmosférica.
c) Existe vácuo no interior da lata.
d) Ao aquecermos a lata, a pressão em seu interior não varia.
e) Ao aquecermos a lata e pressionarmos sua válvula, gases sairão novamente da mesma.
9) Um fato comum em nosso dia a dia é sentir uma certa coceira no nariz quando tomamos de um copo um refrigerante, principalmente quando aberto pela primeira vez, isso ocorre devido a vazão do gás (CO2) que arrasta uma certa quantidade do xarope do mesmo.
Qual das citações da teoria cinética molecular dos gases que mais se adapta a este fato?
Estudo dos Gases
Grandezas relacionadas ao estudo dos gases:
Pressão
É a gradeza relacionada à força que um corpo exerce sobre determinada área. Quanto maior a quantidade de partículas, maior será a pressão exercida pelo gás. As unidades de medida mais comuns são: ( atm, mmHg, Pa e (N/m2). A expressão a seguir relaciona essas unidades de medida:
1 atm = 760 mmHg = 1,013x105 Pa (N/m2)
Volume
É a grandeza relacionada ao espaço ocupado pelo gás em determinadas condições de temperatura e pressão. As unidades mais comuns são o litro (L), decímetro cúbico (dm3), mililitro (ml), centímetro cúbico (cm3).
Temperatura
É a grandeza relacionada à agitação das partículas em um sistema.

As unidades mais utilizadas são o grau Celsius (ºC) e o Kelvin (K). Para converter uma unidade em outra, utiliza-se a seguinte expressão:
T (K, Kelvin) = t (ºC, graus Celsius) + 273
Volume molar e hipótese de Avogadro
Avogadro constatou que, sob as mesmas condições de temperatura e pressão, volumes iguais de gases diferentes contêm o mesmo número de moléculas. Essa constatação ficou conhecida por hipótese de Avogadro. A 0 ºC e 1 atm (condições normais de temperatura e pressão - CNPT), o volume molar corresponde a 22,4 L.
ATIVIDADE
10) Segundo o italiano Lorenzo Romano Amedeo Carlo Avogadro , “quando dois ou mais gases estão ocupando o mesmo volume, nas mesmas condições de temperatura e pressão, apresentam sempre o mesmo número de moléculas”. Baseado na afirmação proposta por ele, temos a seguir alguns recipientes fechados contendo gases, submetidos a uma mesma temperatura e pressão:

Em qual dos recipientes há um maior número de átomos de oxigênio e hidrogênio, respectivamente?
a) I e III b) I e IV c) II e III d) II e IV
Transformações gasosas
São transformações provocadas pela alteração das variáveis de estado (temperatura, pressão e volume) de uma quantidade fixa de gás.
Transformação isotérmica (Lei de Boyle)
É o tipo de transformação gasosa que ocorre quando um gás é comprimido ou dilatado, sob temperatura constante.
p1V1 = p2V2 ou p . V = constante

A representação gráfica de uma transformação isotérmica pode ser observada a seguir:

ATIVIDADE
11) (UNIRIO) Você brincou de encher, com ar, um balão de gás, na beira da praia, até um volume de 1 L e o fechou. Em seguida, subiu uma encosta próxima carregando o balão, até uma altitude de 900 m, onde a pressão atmosférica é 10 % menor do que a pressão ao nível do mar. Considerando que a temperatura na praia e na encosta seja a mesma, o volume de ar no balão, em L, após a subida, será de:
a) 0,8 b) 0,9 c) 1,0 d) 1,1 e) 1,2
Transformação isobárica
É o tipo de transformação gasosa que ocorre quando um gás é aquecido ou resfriado sob pressão constante. Nessa transformação, o volume do gás varia proporcionalmente com a temperatura absoluta do gás.
V1/T1 = V2/T2 ou V/T = constante

A representação gráfica de uma transformação isobárica pode ser observada a seguir:

ATIVIDADE
12) O pneu de um automóvel foi regulado de forma a manter uma pressão interna de 21 libras-força por polegada quadrada, a uma temperatura de 14 ºC. Durante o movimento do automóvel, no entanto, a temperatura do pneu elevou-se a 55 ºC.
Mediante ao enunciado, qual é o volume final do gás no pneu, considerando inicialmente o volume de 42 litros?
Transformação isovolumétrica
É o tipo de transformação gasosa que ocorre em um sistema, sob volume constante.
p1/T1 = p2/T2 ou p/T = constante

A representação gráfica de uma transformação isovolumétrica pode ser observada a seguir:

ATIVIDADE
13) (Mack-SP) Uma determinada massa fixa de gás contido em um balão encontra-se inicialmente em CNTP.
Em uma transformação isovolumétrica, sabendo-se que a pressão máxima interna permitida pelo balão é de 3,0 atm, se dobrarmos a temperatura absoluta inicial, a pressão final do gás e o efeito sobre o balão serão:
a) 2,0 atm e o balão não estoura
b) 2,0 atm e o balão estoura
c) 3,0 atm e o balão estoura
d) 1,5 atm e o balão não estoura
e) 1,0 atm e o balão não estoura
Equação de estado dos gases
Quando, em uma transformação gasosa, pressão, temperatura e volume se alteram, é possível descobrir o valor das variáveis no sistema final por meio da equação da transformação geral dos gases.
pV = nRT
Em que: R = 0,082 L . atm . K-1 . mol-1 = 62,3 L . mmHg . K-1 . mol-1 = 8,314 L . KPa . K-1 . mol-1
ATIVIDADES
14) Um certo gás, cuja massa vale 140g, ocupa um volume de 41 litros, sob pressão 2,9 atmosferas a temperatura de 17°C. O número de Avogadro vale 6,02x1023 e a constante universal dos gases perfeitos R= 0,082 atm.L/mol.K.
Nessas condições, o número de moléculas continuadas no gás é aproximadamente de:
a) 3,00. 1024
b) 5,00. 1023
c) 6,02. 1023
d) 2,00. 1024
e) 3,00. 1029
15) (UFC) Acidentes com botijões de gás de cozinha são noticiados com bastante freqüência. Alguns deles ocorrem devido às más condições de industrialização (botijões defeituosos), e outros por uso inadequado. Dentre estes últimos, um dos mais conhecidos é o armazenamento dos botijões em locais muito quentes. Nestas condições, e assumindo a lei dos gases ideais, é correto afirmar que:
a) a pressão dos gases aumenta, e o seu número de mols diminui.
b) a pressão dos gases diminui, e o seu número de mols diminui.
c) o número de mols permanece constante, e a pressão aumenta.
d) a pressão e o número de mols dos gases aumentam.
e) a pressão e o número de mols dos gases não são afetados pelo aumento de temperatura.
Difusão e efusão
Difusão é o fenômeno em que um gás se espalha em outro meio gasoso. A efusão, por sua vez, é a passagem de um gás por um pequeno orifício do recipiente.
Thomas Graham estudou esses dois fenômenos e constatou que a velocidade de efusão ou de difusão de um gás é inversamente proporcional à raiz quadrada de sua densidade.
ATIVIDADE
16) (UFRGS-RS) Um balão de borracha, desses usados em aniversários, cheio de ar, murcha após algum tempo. O fenômeno pode-se explicar pela:
a) Lei de Avogadro, que se refere à reatividade interna dos componentes.
b) Efusão do gás contido no balão para o meio externo.
c) Lei de Graham, que diz ser a velocidade de difusão diretamente proporcional à massa molar do gás.
d) Alta densidade do gás usado para encher o balão.
e) Pressão interna do gás que enruga o balão.
Tópico: "2º ANO" 1º BIMESTRE-2024: Teoria Cinética Molecular, Estudo dos Gases e Radioatividade
Nenhum comentário encontrado.
