"1º ANO" 4º BIMESTRE-2024: Reações Químicas
Transformação Química (Reação Química)
É aquela mudança que ocorre na constituição da matéria (reagentes), onde os átomos constituintes permanecem os mesmos, porém, organizados de uma nova forma (produtos). Ex// a ferrugem de uma chave, a queima de um papel, o cozimento de um alimento, fotossíntese entre outros.

Representação de uma reação química
_A representação se dá através de uma equação química:
SO3(g) + 2 NaOH(aq) --> Na2SO4(aq) + H2O(l)
ou iônica (presença de íons):
H2O(l) <--> H+(aq) + OH-(aq)
_ As as substâncias reagentes e produtos são assim representados: SO3, NaOH e H2O na 2ª equação; Na2SO4, H2O na 1ª equação, H+ e OH-;
_as substâncias podem ser simples formadas por apenas um tipo de elemento químico (O2) ou composta formada por mais de um tipo de elemento químico (NaOH);
_presença dos estados físicos, que as substâncias se encontram ou em solução aquosa: NaCl(s), NaOH(l), H2O(g) HF(aq);
_catalisadores: Ni (Níquel) sobre a seta (-->);
_coeficientes: quantidade das substâncias presentes na reação, podendo ser considerado em mols ou em moléculas, dependendo do contexto: 2NH3, o dois pode indicar 2 mols ou 2 moléculas de NH3;
_índice (é a quantidade de átomos, dos elementos químicos, que constituem uma molécula da substância): H2SO4, neste caso uma molécula tem 2 átomos de hidrogênio, 1 átomo de enxofre e 4 átomos de oxigênio;
_seta simples "-->": (reação irreversível), onde o reagente se transforma em produto e não há reversão): ex// combustão "queima";
_seta dupla "<-->": (reação reversível), onde o reagente se transforma em produto (reação direta) e este pode se transformar voltando a ser reagente (reação inversa): ex// substância oxigênio, O2, se transforma em ozônio, O3, e este volta a ser substância oxigênio;
_seta inclinada para cima "↗" ao lado de uma substância (liberação desta para o ambiente na forma gasosa);
_seta vertical para baixo "↓" ao lado de uma substância (precipitação desta para o fundo do recipiente sendo o seu estado sólido e não dissolvido).
_o simbolo Δ abaixo da seta, indica aquecimento.
Atividade:
1) Sobre a equação é correto afirmar: Al(s) + H2SO4(aq) → Al2(SO4)3(aq) + H2(g):
a) classificada como iônica.
b) possui 3 substâncias compostas e 1 simples.
c) os três estados fisicos estão presentes.
d) não há presença de catalisador.
2) Observe a reação:
3S-2 + 2CrO4-2 + 16H+ → 3S + 8H2O + 2Cr+3
A quantidade total de partículas (átomos e íons) do lado de reagentes e maior do que em produtos? Justifique:
3) Quais são as reações que ocorrem numa reação reversível? Comente-as:
Tipos de reações químicas
Síntese ou adição: quando duas ou mais substâncias reagem, produzindo ao menos uma substância maior.
3H2 + N2 <--> 2NH3
Análise ou decomposição: quando uma substância se divide em duas ou mais substâncias de estruturas menores.

Deslocamento ou de Substituição ou de Simples troca: quando uma substância simples reage com uma substância composta e "desloca" desta, uma nova substância simples.

Dupla troca ou de Dupla substituição: quando duas substâncias compostas reagem, trocando entre si dois elementos ou radicais, formando a partir daí dois novos compostos.

Atividade:
4) Classifique as reações a seguir:
a) CuCl2 + H2SO4 → CuSO4 + 2HCl
b) Zn + 2HCl → ZnCl2 + H2
c) P2O5 + 3H2O → 2H3PO4
d) CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
e) Cu(OH)2 → CuO + H2O
f) AgNO3 + NaCl → AgCl + NaNO3
g) CaO + CO2 → CaCO3
h) 2H2O → 2H2 + O2
i) Cu + H2SO4 → CuSO4 + H2
j) 2AgBr → 2Ag + Br
Como as reações ocorrem "Teoria das colisões"
*Condições fundamentais:
_afinidade química (um reagente tem que ter afinidade com o outro);
_contato orientado (um reagente tem que colidir com o outro, de forma orientada, frontalmente, com maior superfície de contato possível);
_energia eficaz (energia necessária para quebrar o que existe "os reagentes" e ligar os átomos novamente formando os "produtos")

Atividade:
5) Os gases hidrogênio e oxigênio têm afinidade química para reagir. Porém, se colocarmos esses dois gases em um frasco, eles poderão ficar por tempo indeterminado lá sem que ocorra reação química. Qual fator não foi satisfatório nesse caso?
a) Afinidade química.
b) Colisões orientadas entre as partículas.
c) Contato entre os reagentes.
d) Atingir a energia eficaz.
Lei de Lavoisier (conservação da massa)
_No interior de um recipiente fechado, a massa total não varia, quaisquer que sejam as transformações que venham a ocorrer;
_A soma das massas dos reagentes antes da reação é igual à soma das massas dos produtos após a reação;
_Na natureza, nada se perde, nada se cria; a matéria apenas se transforma.
Ex// C + O2 --> CO2
3g + 8g --> 11g
Modelo atômico de Dalton aplicado à lei de Lavoisier:

Atividade:
6) Na reação de neutralização do ácido clorídrico pelo hidróxido de magnésio, sabe-se que 73 g do ácido reage com 58 g do hidróxido com formação de 36 g de água. Baseado nessas informações e utilizando a Lei de Lavoisier, determine a massa do outro produto dessa reação, o cloreto de magnésio.
Lei de Proust:
_Uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa;
_Se uma substância de uma reação aumenta ou diminui, todas as outras aumentam (multiplicam-se todos os coeficientes por um mesmo valor) ou diminuem (dividem-se todos os coeficientes por um mesmo valor) na mesma proporção.
Ex//
1ª experiência: 3 g de carbono (C) se unem a 8 g de oxigênio (O2), produzindo 11 g de gás carbônico (CO2)
2ª experiência: 6 g de carbono (C) se unem a 16 g de oxigênio (O2), produzindo 22 g de gás carbônico (CO2)
Observa-se que da 1ª para a 2ª experiência houve um aumento das substâncias na mesma proporção (multiplicados por 2).
Modelo atômico de Dalton aplicado à lei de Proust:

Atividade:
7) Sabe-se que 28 g de nitrogênio reagem completamente com 6 g de hidrogênio, formando amônia. Qual será a massa, em gramas, necessária de hidrogênio, quando 140 g de nitrogênio for usada na formação de 170 g de amônia?
Balanceamento de T. Q.
1º passo: Balanceamento de equações químicas por tentativa:
KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Visto que no segundo membro há dois átomos de manganês, conforme mostrado pelo coeficiente, no primeiro também deverá haver. Portanto, temos:
2 KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Com isso, a quantidade de potássio (K) no 1º membro ficou de 2, que será o mesmo coeficiente para esse átomo no segundo membro:
2 KMnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
A quantidade de cloros (Cl) no 2º membro é de 16 no total, por isso o coeficiente do HCl do 1º membro será:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + H2O
O número de hidrogênios do 1º membro é 16, por isso o coeficiente da água (H2O) do 2º membro será igual a 8, pois a multiplicação do índice do hidrogênio (2) por 8 é igual a 16:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
Para conferir se a equação está corretamente balanceada podemos ver dois critérios:
1º) Verificar se a quantidade de cada átomo nos dois membros está igual:
2 KMnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Cl2 + 8 H2O
K =2 K =2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
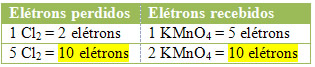
2º) Ver se o número total de elétrons perdidos é igual ao número total de elétrons recebidos:
Balanceamento de equações químicas e iônicas por técnica:
1º passo: Determinar os números de oxidação:
Esse passo é importante porque normalmente não conseguimos visualizar rapidamente quais são as espécies que sofrem oxidação e redução.
1 +7 -2 +1 -1 +1-1 +2 -1 0 +1 -2
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
*2º passo: Determinação da variação da oxidação e da redução:
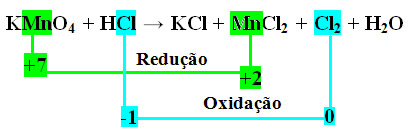
Observe que o manganês (Mn) sofre redução e o cloro (Cl) sofre oxidação.
MnCl2 = ∆Nox = 5 x (1 maior índice de Mn) = 5
Cl2 = ∆Nox = 1 x (2 maior índice de Cl) = 2
No caso do cloro, podemos notar que o HCl originou 3 compostos (KCl, MnCl2, e Cl2), mas o que nos interessa é o Cl2, pois é o seu Nox que sofreu variação. Cada cloro que forma Cl2 perde 1 elétron; como são necessários 2 cloros para formar cada Cl2, são perdidos então dois elétrons.
3º passo: Inversão dos valores de ∆:
Nesse passo, os valores de ∆ são trocados entre as espécies citadas, tornando-se os coeficientes delas:
MnCl2 = ∆Nox = 5 → 5 será o coeficiente de Cl2
Cl2 = ∆Nox = 2→ 2 será o coeficiente de MnCl2
KMnO4 + HCl → KCl + 2 MnCl2 + 5 Cl2 + H2O
Nesse momento já é possível conhecer dois coeficientes da equação.
Observação: normalmente, na maioria das reações, essa inversão de valores é efetuada no 1º membro. Mas, como regra geral, isso deve ser feito no membro que tiver maior número de átomos que sofrem oxirredução. Se esse critério não puder ser observado, invertemos os valores no membro que tiver maior número de espécies químicas. Foi isso o que foi realizado aqui, pois o 2º membro possui mais substâncias.
Por Jennifer Fogaça raduada em Química (fonte: www.brasilescola.com.br)
Atividade:
8) (UFSM-RS) Considere as equações:
I - Al2O3 + HCl → AlCl3 + H2O
II - SO2 + NaOH → Na2SO3 + H2O
III - BaO4 + HNO3 → Ba(NO3)2 + H2O2 + O2
A sequência correta dos coeficientes dos reagentes e produtos necessários para o balanceamento estequiométrico dessas equações é:
I II III
a) 6,3,3,2 / 1,2,1,1 / 2,1,2,2,2
b) 1,6,2,3 / 2,1,1,1 / 1,1,2,1,1
c) 1,3,3,2 / 2,1,2,2 / 1, 2,1,1,1
d) 6,1,2,3 / 2,1,2,2 / 2,1,2,2,2
e) 1,6,2,3 / 1,2,1,1 / 1, 2,1,1,1
"1º ANO" 4º BIMESTRE-2024: Reações Químicas
Nenhum comentário encontrado.
