"2º ANO" 2º BIMESTRE-2025: Soluções e Propriedades Coligativas
Dispersões "Soluções"
Habilidades Cognitivas:
(EM13CNT310X) Investigar e analisar os efeitos de programas de infraestrutura e demais serviços básicos (saneamento, energia elétrica, transporte, telecomunicações, cobertura vacinal, atendimento primário à saúde e produção de alimentos, entre outros) e identificar necessidades locais e/ou regionais em relação a esses serviços, a fim de avaliar e/ou promover ações que contribuam para a melhoria na qualidade de vida no âmbito social, familiar, cultural e econômico.
(EM13CNT203X) Avaliar e prever efeitos de intervenções nos ecossistemas, e seus impactos nos seres vivos e no corpo humano, com base nos mecanismos de manutenção da vida, nos ciclos da matéria e nas transformações e transferências de energia, utilizando representações e simulações sobre tais fatores, com ou sem o uso de dispositivos e aplicativos digitais.
E a relação entre soluto e solvente numa mistura de substancias, onde o soluto é aquele que se dissolve e o solvente e aquele usado para dissolver.
Classificação
_Suspensão: o soluto apresenta um tamanho significativo (a partir de 100 nm) ao ponto de ser visualizado a olho nu (sistema heterogêneo, aquele que apresenta mais de uma fase, aspecto ou cor) sofrendo sedimentação espontânea e filtrados por meio de filtros comuns.

_Solução coloidal: o soluto apresenta um tamanho médio (entre 1nm a 100 nm) ao ponto de ser visualizado por meio de ultramicroscópio, sofrendo sedimentação através do uso de ultracentrifuga e filtrados por meio de ultrafiltros.
Esse tipo de mistura apresenta o efeito Tyndall, quando é possível visualizar a trajetória do feixe de luz que atravessa a mistura.

_Solução Verdadeira: o soluto apresenta um tamanho tão pequeno (abaixo de 1 nm), que não pode ser visualizado, não sofrendo sedimentação e nem podendo ser filtrado, formando um sistema totalmente homogêneo (aquele que apresenta apenas uma fase, aspecto ou cor). O soluto pode ser molecular, por exemplo, o açucar que em solução aquosa não conduz corrente elétrica, ou pode ser iônico, por exemplo, o sal de cozinha que em solução aquosa conduz corrente elétrica.

*As soluções verdadeiras podem ser classificadas em:
_Sólida: liga metálica ouro 18 quilates (mistura de ouro"75%" e prata ou cobre "25%").
_Líquida: álcool etílico doméstico 92,8º INPM "porcentagem em massa (92,8% de massa de álcool etílico + 7,2% de massa de água), que corresponde ao álcool etílico 96º GL porcentagem em volume ( 96,0% de volume de álcool etílico + 4,0% de volume de água).
_Gasosa: ar atmosférico: N2 78%, O2 21%, Ar 0,9%, CO2 0,04% e Outros gases 0,06%
_Gás e líquido: água gaseificada (sem agitação, ou seja, não se observa as bolhas).
_Sólidos e líquidos: água boricada (ácido bórico e água), antisséptico para limpeza de ferimentos.
Atividade
1) (Cesgranrio-RJ) Considere o quadro a seguir:
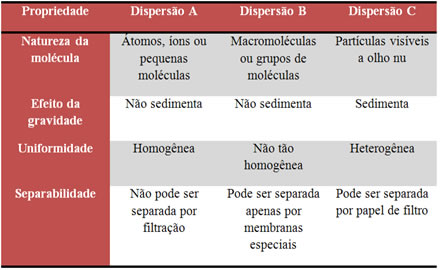
Logo, podemos afirmar que:
a) A = solução verdadeira; B = suspensão; C = solução coloidal.
b) A = suspensão; B = solução coloidal; C = solução verdadeira.
c) A = solução coloidal; B = solução verdadeira; C = suspensão.
d) A = solução coloidal; B = suspensão; C = solução verdadeira.
e) A = solução verdadeira; B = solução coloidal; C = suspensão.
Coeficiente de Solubilidade
Quantidade limite de soluto que pode ser dissolvida em certa quantidade de solvente numa dada temperatura.
Atividade
2) (Unifesp/2002) Uma solução contendo 14 g de cloreto de sódio dissolvidos em 200 mL de água foi deixada em um frasco aberto, a 30°C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo e aproximado, em mL, de água que deve ter evaporado quando se iniciou a cristalização? (Solubilidade, a 30°C, do cloreto de sódio = 35 g / 100 g de água; densidade da água a 30°C = 1,0 g/mL):
a) 20.
b) 40.
c) 80.
d) 160.
Saturação das soluções
_Insaturada: quantidade de soluto menor que o coeficiente de solubilidade.
_Saturada: quantidade de soluto igual ao coeficiente de solubilidade.
_Supersaturada: quantidade de soluto superior ao coeficiente de solubilidade.
Atividade:
3) Observe a tabela de solubilidade abaixo para várias substâncias:
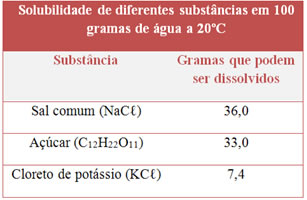
Classifique o tipo de solução (saturada, insaturada ou supersaturada) que obteremos se adicionarmos essas massas de soluto a 100 g de água, à temperatura de 20ºC:
50 g de NaCℓ;
33,0 g de açúcar;
5,0 g de KCℓ.
a) Saturada, supersaturada, insaturada.
b) Saturada, insaturada, saturada.
c) Insaturada, saturada, supersaturada.
d) Supersaturada, insaturada, saturada.
e) Supersaturada, saturada, insaturada.
Concentrações das soluções
_Concentração em massa (C): é a quantidade de massa do soluto, em gramas, dividido pelo volume da solução, em litros: C = m1/V, unidae: g/L
Atividade
4) Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de sódio (NaCl) em 2,0 litros de água. Considerando que o volume da solução permaneceu 2,0 L, qual é a concentração da solução final?
a) 2g/L
b) 4g/L
c) 6 g/L
d) 8 g/L
e) 10 g/L
_Concentração em quantidade de matéria (M): é a quantidade de matéria do soluto, em mols, dividida pelo volume da solução, em litros: M = n1/V, unidade: mol/L
Atividade
5) Qual massa de ácido sulfúrico (H2SO4) será necessária para preparar 2 litros de uma solução na concentração de 3 mol/L? Dado: M(H2SO4)= 98 g/mol.
a) 5,8 g
b) 58 g
c) 588 g
d) 5880 g
_Densidade (d): é a somatória das massas de todas as substâncias da solução, em gramas, dividido pelo volume da solução, em mililitros: d = m/V, unidade: g/mL.
A substância mais densa tende a afundar a menos densa tende a ficar na parte superior.
Atividade
6) Três líquidos (água, benzeno e clorofórmio) foram colocados numa proveta, originando o seguinte aspecto:

A seguir temos uma tabela com as densidades de cada líquido. Baseando-se nessas informações e em seus conhecimentos sobre densidade, relacione as substâncias A, B e C com as mencionadas na tabela. Justifique sua resposta.
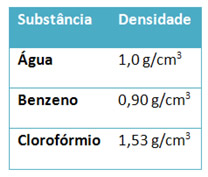
Propriedades Relacionadas a um Líquido
Volatilidade: é a capacidade que uma substância tem para passar para o estado físico gasoso.
Ser mais volátil: é a substância que apresenta mais facilidade para passar para o estado físico gasoso, devido a apresentar menor temperatura de ebulição o que acarreta em envolver menor quantidade de energia absorvida, pois as ligações intermoleculares são menores.
Pressão de Vapor: é a força aplicada por uma substância no estado físico gasoso.

Pressão ou tensão Máxima de Vapor de um Líquido:
É a pressão exercida por seus vapores (vapores saturados) quando estes estão em equilíbrio dinâmico com o líquido, ou seja a velocidade de ebulição do líquido se torna igual à velocidade de condensação de seus vapores.

Observando o esquema acima é bom salientar que devemos nos ater para o fato de haver a pressão externa sobre o sistema, que quanto menor for permitirá o êmbolo subir mais.
Fatores que influenciam na pressão de vapor:
Natureza do líquido: um líquido mais volátil apresenta uma pressão de vapor maior, pois a formação de vapor é mais intensa e consequentemente mais moléculas gasosas estarão exercendo força.

Temperatura: quanto maior a temperatura a substância se encontrar, mais energia cinética ela terá, assim com maior intensidade de movimento mais força o vapor vai aplicar.

Propriedades Coligativas
Habilidades Cognitivas:
(EM13CNT211MG) Analisar e discutir os processos que alteram as propriedades coligativas em especial as que interferem no transporte por membrana celular, na temperatura e pressão de líquidos e gases.
Ao estudarmos as Propriedades Coligativas, passamos a entender que as substâncias quando puras apresentam as propriedades específicas, temperatura de solidificação, temperatura de ebulição e pressão máxima de vapor diferentes para com as soluções, sendo Pressão Máxima de Vapor e T.S. das soluções mais baixas e T.E. mais elevada.
Tonoscopia
No caso de Pressão Máxima de Vapor a uma mesma temperatura uma solução apresenta menos gases (vapor) em relação à uma substância pura, devido ao fato do soluto(s) dissolvido disputar o calor envolvido, prender as moléculas do líquido por ação da força de atração intermolecular, além de formar barreira física de escape do líquido no sistema, o que faz com que a pressão seja menor, o que chamamos de (Efeito Tonoscópico).
Atividade
7) (Vunesp-SP) A uma dada temperatura, possui a menor pressão de vapor a solução aquosa:
a) 0,1 mol/L de C12H22O11.
b) 0,2 mol/L de C12H22O11.
c) 0,1 mol/L de HCℓ.
d) 0,2 mol/L de HCℓ.
e) 0,1 mol/L de NaOH.
Ebulioscopia
No caso de Temperatura de Ebulição isso acontece porque na ebulição de uma solução a medida que esta ferve, o solvente vai evaporando e a concentração da solução vai aumentando, com isso, sua temperatura de ebulição também aumenta (Efeito Ebulioscópico).
Atividade:
8) Digamos que você possui as seguintes amostras:
Água pura.
Solução aquosa de sal de cozinha a 0,2 mol/L.
Solução aquosa de glicose a 0,2 mol/L.
A ordem crescente de temperatura de ebulição dessas amostras é dada por:
a) I > II > III
b) III > II > I
c) III < II < I
d) I < II < III
e) I < III < II
Crioscopia
No caso de Temperatura de Solidificação isso acontece porque na solidificação de uma solução as partículas do solvente tem que se desvencilhar das partículas de soluto(s) dissolvido para se agruparem o que faz a temperatura de solidificação diminuir (Efeito Crioscópico).
Atividade
9) (UFMG) Num congelador há cinco formas que contêm líquidos diferentes para fazer gelo e picolés de limão. Se as formas forem colocadas, ao mesmo tempo, no congelador e estiverem, inicialmente, a mesma temperatura, vai-se congelar por último a forma que contém 500 mL de:
a) água pura.
b) solução, em água, contendo 50 mL de suco de limão.
c) solução, em água, contendo 100 mL de suco de limão.
d) solução, em água, contendo 50 mL de suco de limão e 50 g de açúcar.
e) solução, em água, contendo 100 mL de suco de limão e 50 g de açúcar.
Tópico: "2º ANO" 2º BIMESTRE-2025: Soluções e Propriedades Coligativas
Nenhum comentário encontrado.
