Dispersões "Soluções"
Classificação
Suspensão: o soluto apresenta um tamanho significativo (a partir de 100 nm) ao ponto de ser visualizado a olho nu (sistema heterogêneo, aquele que apresenta mais de uma fase, aspecto ou cor) sofrendo sedimentação espontânea e filtrados por meio de filtros comuns.

Solução coloidal: o soluto apresenta um tamanho médio (entre 1nm a 100 nm) ao ponto de ser visualizado por meio de ultramicroscópio, sofrendo sedimentação através do uso de ultracentrifuga e filtrados por meio de ultrafiltros.
Esse tipo de mistura apresenta o efeito Tyndall, quando é possível visualizar a trajetória do feixe de luz que atravessa a mistura.

Solução Verdadeira: o soluto apresenta um tamanho tão pequeno (abaixo de 1 nm), que não pode ser visualizado, não sofrendo sedimentação e nem podendo ser filtrado, formando um sistema totalmente homogêneo (aquele que apresenta apenas uma fase, aspecto ou cor). O soluto pode ser molecular, por exemplo, o açucar que em solução aquosa não conduz corrente elétrica, ou pode ser iônico, por exemplo, o sal de cozinha que em solução aquosa conduz corrente elétrica.

*As soluções verdadeiras podem ser classificadas em:
Sólida: liga metálica ouro 18 quilates (mistura de ouro"75%" e prata ou cobre "25%").
Líquida: álcool etílico doméstico 92,8º INPM "porcentagem em massa (92,8% de massa de álcool etílico + 7,2% de massa de água), que corresponde ao álcool etílico 96º GL porcentagem em volume ( 96,0% de volume de álcool etílico + 4,0% de volume de água).
Gasosa: ar atmosférico: N2 78%, O2 21%, Ar 0,9%, CO2 0,04% e Outros gases 0,06%
Gás e líquido: água gaseificada (sem agitação, ou seja, não se observa as bolhas).
Sólidos e líquidos: água boricada (ácido bórico e água), antisséptico para limpeza de ferimentos.
Atividade
1) (Cesgranrio-RJ) Considere o quadro a seguir:
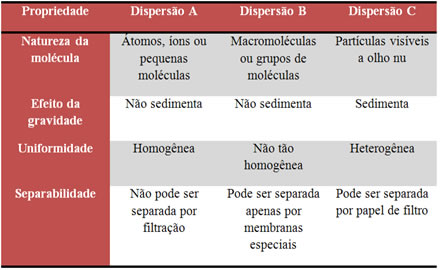
Logo, podemos afirmar que:
a) A = solução verdadeira; B = suspensão; C = solução coloidal.
b) A = suspensão; B = solução coloidal; C = solução verdadeira.
c) A = solução coloidal; B = solução verdadeira; C = suspensão.
d) A = solução coloidal; B = suspensão; C = solução verdadeira.
e) A = solução verdadeira; B = solução coloidal; C = suspensão.
Coeficiente de Solubilidade
Quantidade limite de soluto que pode ser dissolvida em certa quantidade de solvente numa dada temperatura.
Atividade
2) (Unifesp/2002) Uma solução contendo 14 g de cloreto de sódio dissolvidos em 200 mL de água foi deixada em um frasco aberto, a 30°C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo e aproximado, em mL, de água que deve ter evaporado quando se iniciou a cristalização? (Solubilidade, a 30°C, do cloreto de sódio = 35 g / 100 g de água; densidade da água a 30°C = 1,0 g/mL):
a) 20.
b) 40.
c) 80.
d) 160.
Saturação das soluções
Insaturada: quantidade de soluto menor que o coeficiente de solubilidade.
Saturada: quantidade de soluto igual ao coeficiente de solubilidade.
Supersaturada: quantidade de soluto superior ao coeficiente de solubilidade.
Atividade:
3) Observe a tabela de solubilidade abaixo para várias substâncias:
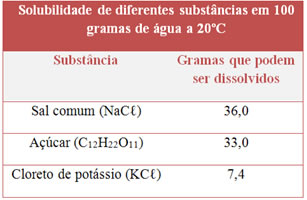
Classifique o tipo de solução (saturada, insaturada ou supersaturada) que obteremos se adicionarmos essas massas de soluto a 100 g de água, à temperatura de 20ºC:
50 g de NaCℓ;
33,0 g de açúcar;
5,0 g de KCℓ.
a) Saturada, supersaturada, insaturada.
b) Saturada, insaturada, saturada.
c) Insaturada, saturada, supersaturada.
d) Supersaturada, insaturada, saturada.
e) Supersaturada, saturada, insaturada.
Concentrações das soluções
Concentração em massa (C): é a quantidade de massa do soluto, em gramas, dividido pelo volume da solução, em litros: C = m1/V, unidae: g/L
Atividade
4) Uma solução foi preparada dissolvendo-se 4,0 g de cloreto de sódio (NaCl) em 2,0 litros de água. Considerando que o volume da solução permaneceu 2,0 L, qual é a concentração da solução final?
a) 2g/L
b) 4g/L
c) 6 g/L
d) 8 g/L
e) 10 g/L
Concentração em quantidade de matéria (M): é a quantidade de matéria do soluto, em mols, dividido pelo volume da solução, em litros: M = n1/V, unidade: mol/L
Atividade
5) Qual massa de ácido sulfúrico (H2SO4) será necessária para preparar 2 litros de uma solução na concentração de 3 mol/L? Dado: M(H2SO4)= 98 g/mol.
a) 5,8 g
b) 58 g
c) 588 g
d) 5880 g
Densidade (d): é a somatória das massas de todas as substâncias da solução, em gramas, dividido pelo volume da solução, em mililitros: d = m/V, unidade: g/mL.
A substância mais densa tende a afundar a menos densa tende a ficar na parte superior.
Atividade
6) Três líquidos (água, benzeno e clorofórmio) foram colocados numa proveta, originando o seguinte aspecto:

A seguir temos uma tabela com as densidades de cada líquido. Baseando-se nessas informações e em seus conhecimentos sobre densidade, relacione as substâncias A, B e C com as mencionadas na tabela. Justifique sua resposta.
Propriedades Relacionadas a um Líquido
Volatilidade: é a capacidade que uma substância tem para passar para o estado físico gasoso.
Ser mais volátil: é a substância que apresenta mais facilidade para passar para o estado físico gasoso, devido a apresentar menor temperatura de ebulição o que acarreta em envolver menor quantidade de energia absorvida, pois as ligações intermoleculares são menores.
Pressão de Vapor: é a força aplicada por uma substância no estado físico gasoso.

Pressão ou tensão Máxima de Vapor de um Líquido:
É a pressão exercida por seus vapores (vapores saturados) quando estes estão em equilíbrio dinâmico com o líquido, ou seja a velocidade de ebulição do líquido se torna igual à velocidade de condensação de seus vapores.

Observando o esquema acima é bom salientar que devemos nos ater para o fato de haver a pressão externa sobre o sistema, que quanto menor for permitirá o êmbolo subir mais.
Fatores que influenciam na pressão de vapor:
Natureza do líquido: um líquido mais volátil apresenta uma pressão de vapor maior, pois a formação de vapor é mais intensa e consequentemente mais moléculas gasosas estarão exercendo força.

Temperatura: quanto maior a temperatura a substância se encontrar, mais energia cinética ela terá, assim com maior intensidade de movimento mais força o vapor vai aplicar.

Propriedades Coligativas

